重金属是对生态环境危害极大的一类污染物, 含重金属离子废水的处理一直受到人们的关注, 其中镉(Cd2+)是一种广泛应用的、污染面积最广、危害最大的重金属元素之一, 因而镉污染及其治理受到高度关注[1]。当重金属离子的质量浓度较低时(低于100 mg/L), 与微生物修复技术相比, 传统的物理化学处理方法处理效率较低且操作费用和原材料的成本相对过高, 使得微生物修复成为最具有发展和应用前景的生物修复技术之一。
近些年来, 越来越多的研究人员开始关注产铁载体菌在重金属微生物修复中的潜在应用[2-4]。铁载体是细菌、真菌或植物在低铁条件下分泌的用于摄取铁的低分子量螯合剂(200~2 000 u)[5]。研究表明, 铁载体不仅能结合铁离子, 也能结合Cd2+、Cu2+、Ni2+、Pb2+、Zn2+等其他金属离子[6-10]。另有研究表明,耐性细菌的铁载体产量会因为外界环境重金属离子的胁迫作用而发生变化,如在Cd2+胁迫下,铜绿假单胞菌KUCd1的铁载体产量会增多[11],Pb2+胁迫能促进铜绿假单胞菌4EA进一步分泌铁载体[12],链霉菌在重金属Al3+、Cd2+、Cu2+和Ni2+等胁迫下,其合成分泌铁载体的活动会受到影响[13]。在重金属胁迫下, 细菌铁载体的产生可能具有抵抗重金属毒害的作用[14-15]。然而, 目前绝大多数研究仅仅关注重金属浓度对铁载体产量的影响, 未能研究铁载体在重金属去除中的作用。为了将产铁载体菌更好地应用于重金属污染水体和土壤的修复技术, 就必须进一步地了解产铁载体菌与重金属的相互作用。本研究选取高效除镉菌Pseudoaltermonas sp. SCSE709-6作为代表微生物, 对菌体产铁载体规律, 镉胁迫下铁载体的产量变化以及铁载体对菌体耐受、去除Cd2+的影响进行了研究, 分析产铁载体微生物与重金属的作用机理。
1 材料和方法 1.1 试验材料试验菌株:假交替单胞菌Pseudoaltermonas sp. SCSE709-6, 由本课题组筛选, 保藏于中国典型培养物保藏中心。该菌的高效除镉能力已有较多报道[16-19]。
试验试剂:胰蛋白胨, 酵母粉, 海水素, 琼脂, 十六烷基三甲基溴化铵, 铬天青(C23H13Cl2Na3O9S, CAS), 醋酸, 盐酸, 硫酸, 氢氧化钠, 磺胺, 碘, 碘化钾, 亚砷酸钠, 亚硝酸钠, 钼酸钠, 五水硫酸铜, 盐酸羟胺, 儿茶酚, 邻苯二甲酸氢钾, 均为分析纯, 购自国药集团。
Luria-Bertani培养液(LB培养液):配制每升培养液, 在950 ml去离子水中加入胰蛋白胨10 g, 酵母粉3 g, 海水素33 g, 用1 mol/L NaOH调pH至7.0, 用去离子水定容至1 L。在120 ℃蒸汽灭菌20 min, 冷却至室温备用。
1.2 试验设计 1.2.1 铁载体的定性检测通用检测方法——铬天青平板覆盖法[20-21]。取0.121 g CAS溶于50 mL蒸馏水中, 并与2 mL 1 mmol/L FeCl3溶液混匀, 得溶液a; 取0.015 g十六烷基三甲基溴化铵溶于8 mL蒸馏水中, 得溶液b。将a液缓慢加b液中, 充分混匀即得CAS染液。之后, 向250 mL LB培养液中加入琼脂3.75 g, 再沿瓶壁加入CAS染液20 mL, 充分摇匀即得蓝色定性检测培养基。
铁载体类型检测试验:根据特征官能团不同, 可以将微生物产生的铁载体分为四类。大多数细菌分泌的铁载体是儿茶酚型, 有些细菌分泌的则是羟基羧酸盐型或者氧肟酸盐型, 也有细菌分泌的铁载体包含多种官能团, 为混合型铁载体。可用羟基羧酸盐型检测方法、Csaky法和Arnow法进行检测。为了鉴定P.sp.SCSE709-6所产铁载体的类型, 本研究将培养至稳定期的培养液用截留分子量为2 000 u的聚醚砜超滤膜超滤, 收集滤出液。将超滤液真空冷冻干燥, 得浅黄色的超滤冻干粉末, 装入干净的离心管中, 于干燥器内保存, 以便进一步检测。
羟基羧酸盐检测[22]:取1 mL铁载体粉末溶液(10 g/L), 加入1 mL质量分数为750 mmol/L CuSO4溶液, 加入2 mL pH为4.0的醋酸缓冲液(0.2 mol/L), 用UV-3100型分光光度计扫描190~280 nm的紫外光谱图, 以去离子水作为空白对照。
Csaky法检测氧肟酸盐[23]:取1 mL铁载体粉末溶液(10 g/L)加入安瓿瓶中, 加入1 mL 3 mol/L硫酸, 用酒精喷灯封口, 120 ℃, 水解4 h。冷却后将水解液倒入25 mL比色管中, 然后依次加入3.5 mL 2 mol/L乙酸钠溶液、1 mL 1%磺胺溶液、1 mL碘-碘化钾溶液、1 mL邻苯二甲酸氢钾缓冲液, 充分混匀, 室温静置, 反应5 min。加入1 mL质量分数为2%的亚砷酸钠溶液, 混合均匀, 以去除反应液中过量的碘。再加入1 mL N-(1-萘)-乙二胺溶液, 加水稀释定容至25 mL, 反应30 min, 观察溶液颜色变化, 用1 cm的比色皿测定543 nm处的光密度D(543)。以盐酸羟胺溶液作为阳性对照, 以水作为阴性对照。
Arnow法检测儿茶酚盐[24]:取1 mL铁载体粉末溶液(10 g/L)加到5 mL离心管中, 然后依次加入1 mL 0.5 mol/L HCl溶液、1 mL亚硝酸—钼酸试剂、1 mL 1 mol/L NaOH溶液, 充分混匀, 加水至5 mL, 观察溶液颜色变化, 用1 cm的比色皿测定510 nm处的光密度D(510)。以1 mL 100 μmol/L儿茶酚溶液作为阳性对照, 以水作为阴性对照。
1.2.2 铁载体的定量检测将活化24 h的P. sp. SCSE709-6菌液按5 %接种量转接到三个装有200 mL LB培养液的500 mL锥形瓶中, 25 ℃, 200 r/min。接种第一天分别经过3、6、9、12、18、24 h取4 mL培养液测定600 nm波长下光密度并记为D(600), 用于反映菌体生长情况; 取2 mL培养液上清液, 与2 mL CAS检测液混合, 测定630 nm波长下光密度并记为D(630)样品, 每次测量均以同等体积的未接菌的LB培养液与检测液混合作为空白对照D(630)空白, 铁载体产量=100[(D(630)空白-D(630)样品)/D(630)空白], 单位为%[25]。接种第一天以后每12 h进行生物量和铁载体产量的测定, 直至达到稳定期。每份样品有三个平行样, 取平均值进行计算。
1.2.3 镉对铁载体产量的影响配制不同浓度的含镉培养液(Cd2+的浓度分别为0、0.1、0.2、0.3、0.4 mmol/L)。将菌株活化24 h后, 以5%的接种量接种到含不同浓度镉的200 mL LB培养液中, 25 ℃, 200 r/min摇床培养, 测定600 nm波长下光密度并记为D(600), 用于反映菌体生长情况。用1.2.1中的方法测定菌体上清液铁载体产量。每份样品有三个平行样, 取平均值进行计算。
1.2.4 铁载体对除镉效率的影响对于菌株P. sp. SCSE709-6来说, 当镉浓度超过0.50 mmol/L时, 会延长其适应期, 但并不会降低菌株对数生长期的生长速率, 对生物量的减少作用也较小[26]。因此, 本研究设置不同浓度的含镉培养液(Cd2+的质量浓度分别为0.50, 0.75, 1.00 mmol/L), 利用1.2.1获得的铁载体超滤冻干粉末, 设计不同的铁载体浓度(Siderophore的质量浓度分别为0、5、10、20 g/L), 将菌株活化24 h后, 以5 %的接种量接种到含不同浓度镉的200 mL LB培养液中, 25 ℃, 200 r/min摇床培养, 每12 h测定600 nm波长下光密度并记为D(600), 用于反映菌体生长情况。菌液10 000 r/min离心分离后, 利用原子吸收分光法测定上清液中剩余的镉离子浓度。每份样品有三个平行样, 取平均值进行计算。
2 结果和讨论 2.1 铁载体的定性检测细菌分泌的铁载体能螯合铬天青染液中的Fe3+而导致培养基颜色由蓝变橙。假交替单胞菌P. sp. SCSE709-6在铬天青蓝色检测板上培养7 d后的结果如图 1所示。没有微生物的铬天青检测平板, 未观察到培养基颜色的变化如图 1(a)。图 1(b)中菌落周围产生淡黄色晕圈, 表明P.sp.SCSE709-6确实能够产生铁载体。
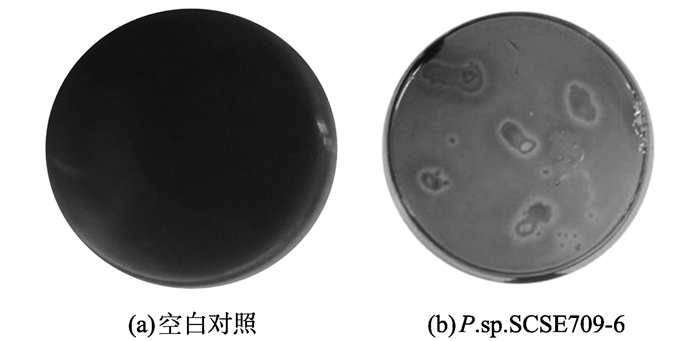
|
图 1 铬天青平板覆盖法检测结果 Figure 1 Detection of siderophore upon O-CAS assay |
氧肟酸盐可以使Csaky试剂呈紫红色, 铁载体粉末溶液检测结果显示淡黄色, 为阴性结果, 说明P. sp. SCSE709-6铁载体不是氧肟酸盐型。儿茶酚盐可以使Arnow试剂呈现紫红色, 铁载体粉末溶液检测结果显示为无色, 为阴性结果, 说明P. sp. SCSE709-6铁载体不是儿茶酚盐型。羟基羧酸盐型铁载体与CuSO4形成的络合物在190~280 nm间有统一的吸收峰。图 2是以吸收率(1-T)/%为纵坐标的紫外光谱图。可以看出P.sp.SCSE709-6所产铁载体与CuSO4形成的络合物在258.00 nm处有一吸收峰, 表明P. sp. SCSE709-6铁载体属于羟基羧酸盐型。

|
图 2 P. sp. SCSE709-6所产铁载体紫外光谱图 Figure 2 Ultraviolet spectra of carboxylate siderophore by P. sp. SCSE709-6 |
综上, P. sp. SCSE709-6能够分泌羟基羧酸盐型铁载体。
2.2 菌体产铁载体规律菌液中铁载体量随生长曲线记录下来, 结果如图 3所示。铁载体的累积趋势与其生长趋势相一致, 这表明铁载体产量与细菌生物量相关。从图 3可以看出, 活化24 h后的P. sp. SCSE709-6在接种LB培养液后没有出现停滞期, 铁载体量从对数期前期(6 h)开始累积, 至稳定期后期(96 h)菌液中铁载体量达到稳定, 峰值为22.14%。不同于Payne等人提到的最大铁载体量出现在对数期晚期以及稳定期早期[25], P. sp. SCSE709-6铁载体量出现在稳定期晚期, 滞后于其生长高峰, 表明铁载体有一定的累积性。铜绿假单胞菌ZGKD2、芽孢杆菌JHT3、DET6也表现出这样的累积性[15, 27]。

|
图 3 菌体生长曲线、铁载体产量变化 Figure 3 Growth curve and siderophore production |
为了探究镉对P. sp. SCSE709-6菌株铁载体产量的影响, 首先研究镉对其生长的影响。在0~0.4 mmol/L范围内, 菌体生长和铁载体产量的百分比变化情况如图 4所示。随着Cd2+浓度的提高, 菌体生长逐渐受到抑制, 但铁载体产量却呈现先增多后减少的趋势。当Cd2+浓度为0.4 mmol/L时, 菌体生长减少了5%。当Cd2+浓度为0.2 mmol/L时, 铁载体产量增多了6.8%, 当Cd2+浓度为0.4 mmol/L时, 铁载体产量减少了15.3%。耐Cd铜绿假单胞菌KUCd1在0~4 mmol/L的CdCl2中, 以及耐Pb铜绿假单胞菌4EA在0~8 mmol/L的Pb2+, 产铁载体量也表现出先增后减的趋势[11-12]。这种变化可能是由于重金属离子的存在, 形成了重金属离子—铁载体复合物, 使得细菌没有获得生长所需要的铁离子, 因此细菌分泌出更多的铁载体进入培养液[28]。但随着重金属离子浓度的进一步升高, 重金属离子进入到细胞内导致氧化胁迫最终导致DNA损伤[29], 使得菌体合成分泌铁载体活动受到抑制。
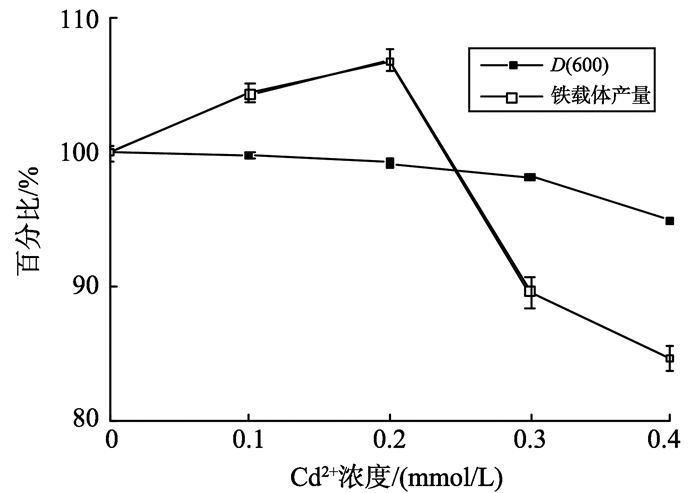
|
图 4 镉浓度对菌体生长、铁载体产量的影响 Figure 4 Effects of Cd2+concentrations on growth andsiderophore production |
为了探究铁载体对P. sp. SCSE709-6菌株除镉效率的影响, 首先研究铁载体对其生长的影响。由图 5可知, 当镉浓度为0.50 mmol/L时, 投加铁载体没有缩短适应期, 相反随着投加量的增多使得菌体对镉离子的去除率降低。当铁载体投加量为20 g/L时, 去除率降低了7.5%, 这可能是由于细菌自身产生的铁载体足以应对外界的镉浓度, 投加铁载体影响了细菌的自身分泌, 使得去除效率降低。当镉浓度超过0.50 mmol/L时, 细菌生长受到明显影响, 投加铁载体能够缩短适应期, 20 g/L的铁载体投加量将适应期缩短为72 h(0.75 mmol/L), 84 h(1.00 mmol/L), 这与氧肟酸盐型铁载体可以使镉的毒性减弱相类似[6]。与此同时, 随着适应期的缩短, 菌体在对数期的迅速生长使得菌体在较短的时间内实现对镉离子的高去除率, 即除镉效率提高。在产铁载体海洋蓝细菌去除放射性金属铀中, 也观测到有类似的现象发生[7]。因此, P. sp. SCSE709-6产生的羟基羧酸盐型铁载体与Cd2+在胞外介质中进行结合, 降低活性重金属镉离子浓度, 从而降低了重金属的毒性, 缩短适应期, 提高除镉效率。
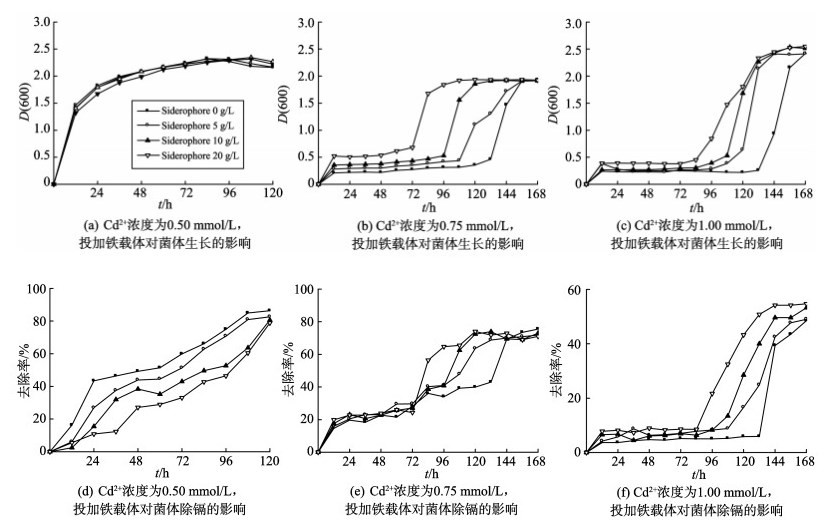
|
图 5 不同镉浓度下, 投加铁载体对细菌生长、除镉的影响 Figure 5 Effects of siderophore on growth and removal rate at different concentrations of Cd2+ |
假交替单胞菌Pseudoaltermonas sp. SCSE709-6能够产生羟基羧酸盐型铁载体, 并且菌液中的铁载体量从对数期开始累积, 稳定期时菌液中铁载体量达到稳定, 其产量与生物量相关。在Cd2+浓度为0~0.4 mmol/L时铁载体量呈先增后减的趋势, 当Cd2+为0.2 mmol/L时铁载体量最大。添加铁载体后, 菌体在高浓度镉环境中的适应期变短, 对Cd2+去除效率提高, 这是因为铁载体能够与Cd2+络合, 降低其生物毒性, 缩短适应期。研究结果为P. sp. SCSE709-6高效除镉提供了一种科学解释, 在重金属生物修复中具有潜在的实际应用价值。
| [1] |
付瑾, 谢学辉, 钱林, 等. 皮氏罗尔斯通氏菌株Dx-T3-01的耐镉性能及镉富集机理[J].
应用与环境生物学报, 2011(5): 717-721 FU Jin, XIE Xuehui, QIAN Lin, et al. Cadmium tolerance and bio-accumulation mechanisms of Ralstonia pickettii strain DX-T3-01[J]. Chinese Journal of Applied & Environmental Biology, 2011(5): 717-721 |
| [2] | GAONKAR T, BHOSLE S. Effect of metals on a siderophore producing bacterial isolate and its implications on microbial assisted bioremediation of metal contaminated soils[J]. Chemosphere, 2013, 93(9): 1835-1843 DOI:10.1016/j.chemosphere.2013.06.036 |
| [3] | GIOVANELLA P, CABRAL L, COSTA A P, et al. Metal resistance mechanisms in gram-negative bacteria and their potential to remove Hg in the presence of other metals[J]. Ecotoxicology and Environmental Safety, 2017(6): 162-169 |
| [4] | DIMKPA C O, MERTEN D, SVATOŠ A, et al. Metal-induced oxidative stress impacting plant growth in contaminated soil is alleviated by microbial siderophores[J]. Soil Biology and Biochemistry, 2009, 41(1): 154-162 DOI:10.1016/j.soilbio.2008.10.010 |
| [5] | SCHWYN B, NEILANDS J B. Universal CAS assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56 DOI:10.1016/0003-2697(87)90612-9 |
| [6] | NAIR A, JUWARKAR A A, SINGH S K. Production and characterization of siderophores and its application in arsenic removal from contaminated soil[J]. Water, Air, and Soil Pollution, 2007, 180(1-4): 199-212 DOI:10.1007/s11270-006-9263-2 |
| [7] | SINGH A, KAUSHIK M S, SRIVASTAVA M, et al. Siderophore mediated attenuation of cadmium toxicity by paddy field cyanobacterium Anabaena oryzae[J]. Algal Research, 2016(4): 63-68 |
| [8] | RASHMI V, SHYLAJANACIYAR M, RAJALAKSHMI R, et al. Siderophore mediated uranium sequestration by marine cyanobacterium Synechococcus elongatus BDU 130911[J]. Bioresource Technology, 2013(4): 204-210 |
| [9] | AHMED E, HOLMSTROM S J. Siderophores in environmental research: roles and applications[J]. Microb Biotechnol, 2014, 7(3): 196-208 DOI:10.1111/1751-7915.12117 |
| [10] | ALBRECHT-GARY A M, CRUMBLISS A L. Cheminform abstract: coordination chemistry of siderophores: thermodynamics and kinetics of iron chelation and release[J]. Cheminform, 1998, 29(19): 293-307 |
| [11] | SINHA S, MUKHERJEE S K. Cadmium—induced siderophore production by a high Cd-resistant bacterial strain relieved Cd toxicity in plants through root colonization[J]. Current Microbiology, 2008, 56(1): 55-60 DOI:10.1007/s00284-007-9038-z |
| [12] | NAIK M M, DUBEY S K. Lead-enhanced siderophore production and alteration in cell morphology in a Pb-resistant Pseudomonas aeruginosa Strain 4EA[J]. Current Microbiology, 2011, 62(2): 409-414 DOI:10.1007/s00284-010-9722-2 |
| [13] | DIMKPA C O, SVATOS A, DABROWSKA P, et al. Involvement of siderophores in the reduction of metal-induced inhibition of auxin synthesis in Streptomyces spp[J]. Chemosphere, 2008, 74(1): 19-25 DOI:10.1016/j.chemosphere.2008.09.079 |
| [14] | BRAUD A, GEOFFROY V, HOEGY F, et al. Presence of the siderophores pyoverdine and pyochelin in the extracellular medium reduces toxic metal accumulation in Pseudomonas aeruginosa and increases bacterial metal tolerance[J]. Environmental Microbiology Reports, 2010, 2(3): 419-425 DOI:10.1111/j.1758-2229.2009.00126.x |
| [15] |
张玉秀, 王姣, 柴团耀, 等. 铜绿假单胞菌ZGKD2的重金属耐性机制研究[J].
环境科学, 2012(10): 3613-3619 ZHANG Yuxiu, WANG Jiao, CHAI Tuanyao, et al. Mechanism of heavy-metal tolerance in Pseudomonas aeruginosa ZGKD2[J]. Environmental Science, 2012(10): 3613-3619 |
| [16] | ZHOU W, LIU D, ZHANG H O, et al. Bioremoval and recovery of Cd(Ⅱ) by Pseudoalteromonas sp. SCSE709-6: comparative study on growing and grown cells[J]. Bioresource Technology, 2014(15): 145-151 |
| [17] | ZHOU W, ZHANG H O, MA Y, et al. Bio-removal of cadmium by growing deep-sea bacterium Pseudoalteromonas. sp. SCSE709-6[J]. Extremophiles, 2013, 17(5): 723-731 DOI:10.1007/s00792-013-0554-4 |
| [18] | JIANG L, ZHOU W, LIU D, et al. Biosorption isotherm study of Cd2+, Pb2+ and Zn2+ biosorption onto marine bacterium Pseudoalteromonas sp. SCSE709-6 in multiple systems[J]. Journal of Molecular Liquids, 2017(23): 230-237 |
| [19] |
张海欧, 周维芝, 马玉洪, 等. 微生物胞外聚合物对重金属镉的解毒作用及红外光谱分析[J].
光谱学与光谱分析, 2013(11): 3041-3043 ZHANG Haiou, ZHOU Weizhi, MA Yuhong, et al. FTIR spectrum and detoxication of extracellular polymeric substances secreted by microorganism[J]. Spectroscopy and Spectral Analysis, 2013(11): 3041-3043 DOI:10.3964/j.issn.1000-0593(2013)11-3041-03 |
| [20] |
王卫星, 周晓伦, 李忠玲, 等. CAS平板覆盖法检测氢氧化细菌铁载体[J].
微生物学通报, 2014, 41(8): 1692-1697 WANG Weixing, ZHOU Xiaolun, LI Zhongling, et al. Detection of siderophore production from hydrogen-oxidizing bacteria with CAS overlay plate method[J]. Microbiology, 2014, 41(8): 1692-1697 |
| [21] | PÉRZ-MIRANDA S, CABIROL N, GEORGE-TÉLLEZ R, et al. O-CAS, a fast and universal method for siderophore detection[J]. Journal of Microbiological Methods, 2007, 70(1): 127-131 DOI:10.1016/j.mimet.2007.03.023 |
| [22] |
孙红启. 铁载体和铁离子对细菌生长过程的影响[D]. 济南: 山东大学, 2008.
SUN Hongqi. Effects of siderophore and ferric ion on bacterial growth process[D]. Jinan: Shandong University, 2008. |
| [23] | CSÁKY T Z. On the estimation of bound hydroxylamine in biological materials[J]. Acta Chemica Scandinavica, 1948, 2(1): 450-454 |
| [24] | ARNOW L E. Colorimetric determination of the components of 3, 4-dihydroxyphenylalanine tyrosine mixtures[J]. Journal of Biological Chemistry, 1937, 118(2): 531-537 |
| [25] | PAYNE S M. Detection, isolation, and characterization of siderophores[J]. Methods in Enzymology, 1994(7): 329-344 |
| [26] |
马玉洪. 深海高效除镉菌株的筛选及其镉去除特性研究[D]. 济南: 山东大学, 2012.
MA Yuhong. Screening of deep sea bacteria for bioremoval of cadmium and study of removal properties[D]. Jinan: Shandong University, 2008. |
| [27] | PATEL A K, DESHATTIWAR M K, CHAUDHARI B L, et al. Production, purification and chemical characterization of the catecholate siderophore from potent probiotic strains of Bacillus spp.[J]. Bioresource Technology, 2009, 100(1): 368-373 DOI:10.1016/j.biortech.2008.05.008 |
| [28] | GAONKAR T, BORKAR S. Applications of siderophore producing marine bacteria in bioremediation of metals and organic compounds[M]. Marine Pollution and Microbial Remediation. Singapore: Springer, 2017: 177-187. |
| [29] | VALKO M, MORRIS H, CRONIN M T. Metals, toxicity and oxidative stress[J]. Current Medicinal Chemistry, 2005, 12(10): 1161-1208 DOI:10.2174/0929867053764635 |




