近年来, 随着城镇化和工业化的加快, 水体富营养化已成为全球共同面临的水环境污染问题, 受到各国关注[1]。截止到2014年, 我国富营养化湖泊的比例高达70%[2]。氮是引发水体富营养化的主要营养元素之一, 当湖泊、水库等封闭水域中无机态总氮含量高于0.2 mg/L时, 就可能引发水体富营养化[3]。污水处理厂二级出水不达标排放造成的水体超负荷纳污是引发水体富营养化的一个主要原因[4]。由此可见, 对污水处理厂的二级出水进行深度处理, 进一步降低出水中氮的浓度可以有效减少富营养化现象的发生[5]。
二级出水中氮的深度去除方法包括物理化学法和生物法。常用的物理化学法有混凝沉淀法、电化学氧化法, 这类方法通常需要向二级出水中投加药品以达到水处理效果, 增加了二级出水处理的成本, 还会引发二次污染[6-7]。生物法是利用微生物的生长代谢将二级出水中的氮转化为有机氮储存在细胞内或通过反硝化作用将其转化为氮气释放到空气中[8-9]。这种方法虽然成本较低, 但是需要为微生物的生长代谢提供充足的有机碳源和能源[10]。研究表明, 当污水中m(C): m(N)≤7时, 就会严重抑制微生物的生长, 降低氮去除效率[11]。而二级出水碳氮比低, 氮形态(无机氮与有机氮)复杂, 增加了生物法处理的难度[11-12]。因此, 需要寻找一种有效的方法来去除二级出水中的氮。
微藻作为一种兼养性原生微生物, 既可以利用培养基中的有机碳, 也可以通过光合作用利用无机碳合成供自身生长所需的物质[13]。微藻生长速度快, 油脂含量高, 是有前途的生物柴油原料, 有着巨大的经济环境效益。与其它微藻相比, 钝顶螺旋藻具有很强的氮同化能力, 能够将水中的氮转化为蛋白质储存在生物质中, 藻体中蛋白质的的质量分数高达70%(干重)[14]。基于其生理和代谢特征, 钝顶螺旋藻已经被逐渐应用于污水中氮的去除和回收[15]。文献[9]指出钝顶螺旋藻可以有效去除黑水(海水冲厕废水)与灰水(家用冲洗污水)混合废水中的氮, 培养12 d后, 污水中氨氮和总氮的去除率分别为94.89%与79.96%。文献[16]利用钝顶螺旋藻来去除人类尿液中的氮, 结果表明, 尿液中的氨氮和尿素都能被有效去除, 去除效率分别为97%和87%。上述废水中都含有充足的营养物质, 而利用钝顶螺旋藻去除低有机碳和低营养物质负荷的废水中氮的研究还很少。本研究主要探索二级出水中不同氮形态对钝顶螺旋藻生长及深度除氮性能的影响, 明确低营养物质负荷下钝顶螺旋藻的氮去除途径和方式, 为螺旋藻处理二级出水的工程应用提供理论依据。
1 试验 1.1 试剂与仪器化学试剂:无水葡萄糖, 无水乙酸钠, NH4Cl, KNO3, NaNO2, 脲等, 以上试剂均为分析纯。
仪器:光照培养箱(HYG-A), 江苏太仓; 紫外-可见分光光度仪(UV-5100), 上海元析; PHS-3C型精密pH计, 上海雷磁; 高速冷冻离心机(CT15RT), 上海天美; 立式压力蒸汽灭菌锅(LDZX-3DKBS), 上海申安; 超声细胞破碎仪(Scientz-IID), 宁波新芝。
1.2 钝顶螺旋藻种液培养本研究中使用的钝顶螺旋藻来自于中国科学院淡水藻库。培养螺旋藻种液使用的培养基是经过高压灭菌锅(121 ℃, 20 min)灭菌处理的Zarrouk培养基(Zarrouk Medium, ZM)[17]。为了保证藻体的单一性, 每周将钝顶螺旋藻悬浮液通过0.45 μm醋酸纤维素膜过滤并且重新接种于灭菌后的ZM中。钝顶螺旋藻在光照培养箱中静置培养, 条件为28 ℃、5 000 lx连续光照。
1.3 批次试验 1.3.1 模拟二级出水配置一般二级出水中营养物质的质量浓度为:COD 100 mg/L, TP 3 mg/L, TN 25 mg/L[18]。本研究分别以无机氮(氨氮、硝氮、亚硝氮)和尿素(Urea)为唯一氮源培养钝顶螺旋藻, 阐明不同氮形态对钝顶螺旋藻生长及深度除氮性能的影响。
1.3.2 试验方法不同氮形态的合成二级出水经121 ℃高温灭菌20 min后分装于500 mL锥形瓶中, 每个锥形瓶中二级出水的体积为250 mL。将ZM培养基中的钝顶螺旋藻种液于6 000 g, 4 ℃离心20 min, 得到的藻体用无菌水洗涤3次后, 接种到灭菌的二级出水中。未接种的废水作为空白。所有锥形瓶均于光照培养箱中静置培养, 设定温度28 ℃, 光暗比为14: 10 h, 光密度为90 μmol·m-2·s-1。每隔24 h取样测定钝顶螺旋藻的生长情况及废水水质参数, 每个数据点由三个平行样测定值计算得到。
1.3.3 分析方法由于均匀藻液的光密度与藻体干重间存在线性关系, 因此使用紫外—可见分光光度计测定均匀藻液在560 nm处的光密度D(560), 螺旋藻的生物量根据藻体干重(dry weight, DW)对D(560)的标准曲线进行计算。将不同光密度(0.10—1.20)的藻体于80 ℃烘干至恒重, 冷却后测定藻体干重。D(560)对藻体干重的标准曲线(见图 1)为y=0.432x-0.028 7(R2=0.995 8), R表示标准曲线的相关性系数。

|
图 1 钝顶螺旋藻D(560)对藻体干重的标准曲线 Figure 1 Standard curve between D(560) and dry weight of Spirulina platensis |
生长速率G是指单位时间内钝顶螺旋藻生物量的增加量, 计算公式为
| $ G = \left( {{W_i} - {W_j}} \right)/\left( {{d_i} - {d_j}} \right) $ |
式中:Wi、Wj分别表示培养第i天与第j天后藻体的干重(i=0, 1, 2, 3, 4; j > i, j=1, 2, 3, 4, 5);di、dj分别表示微藻培养时间为第i天与第j天。
取30 mL藻液于8 000 g, 4 ℃下离心10 min, 将上清液稀释至合适的浓度。参照《水和废水的分析检测方法》对二级出水中pH、氨氮、硝氮、亚硝氮、总氮进行测定[19]。
氮去除速率V是指单位时间内钝顶螺旋藻去除的总氮的量。计算公式为
| $ V = \left( {{C_i} - {C_j}} \right)/\left( {\left( {{W_i} - {W_j}} \right) \cdot \left( {{d_i} - {d_j}} \right)} \right) $ |
式中:Ci为第i天模拟二级出水中总氮的质量浓度; Cj为第j天模拟二级出水中总氮的质量浓度。
取10 mL钝顶螺旋藻藻液于8 000 g, 4 ℃下离心10 min, 得到的藻体用去离子水洗涤三次, 再用去离子水将藻体重悬至原体积, 然后用超声细胞破碎仪超声处理10 min(2 min×5次)。取适量处理后的藻液样品, 参照《水和废水的分析检测方法》经过消化处理并测定其中的总氮。
利用IBM SPSS (Statistical product and service solutions)统计分析软件进行Pearson's相关性分析。所有测试设有三个平行样, 显著性差异的置信区间为99%, 显著性水平P > 0.01表示无差异, P < 0.01有差异, “**”表示差异性显著。
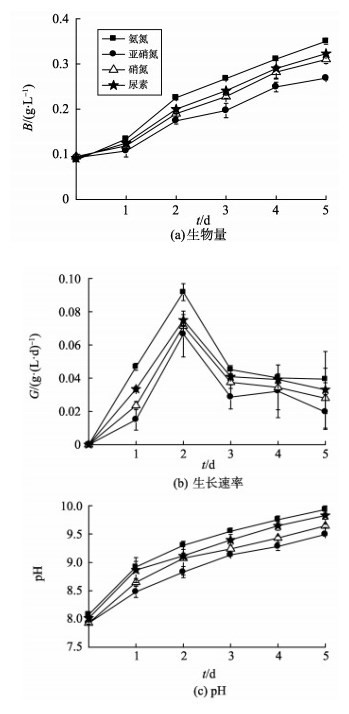
2 结果与讨论 2.1 不同氮源对钝顶螺旋藻生长的影响氮在微藻的生命活动中占有重要地位, 是微藻细胞合成蛋白质、核酸和叶绿素的基本元素[19]。氮在废水中既可以可溶性无机氮(氨氮、硝氮、亚硝氮)形式存在, 也可以可溶性有机氮(尿素)形式存在, 且氮源的种类会对微藻的生长和繁殖产生影响[12]。如图 2(a)和(b)所示, 钝顶螺旋藻可以利用无机氮(氨氮、硝氮、亚硝氮)和有机氮(尿素)进行生长, 且在接入废水后均没有明显的延滞期。当二级出水中的氮源分别为氨氮、硝氮、亚硝氮、尿素时, 微藻的生长速率均在培养2 d后达到最大值, 分别为0.092、0.067、0.072、0.075 mg/(L·d)。培养5 d后, 螺旋藻的最终生物量分别为0.35、0.27、0.31、0.32 g/L。在相同培养时间内, 微藻以氨氮为氮源时, 藻体生长速率与最终生物量均高于其他氮形式; 而以亚硝氮为氮源时, 由于其生物毒性, 微藻的生长速率与最终生物量均最低。如图 2(c)所示, 当二级出水中的氮源分别为氨氮、硝氮、亚硝氮、尿素时, 培养5 d后, 二级出水的最终pH值分别为9.94、9.59、9.65、9.83。pH值的变化与钝顶螺旋藻生长具有相同的规律, 随着生物量的增加, 二级出水最终pH值也不断增加。为揭示螺旋藻生物量与二级出水pH之间的关系, 对两者进行了Pearsons相关性分析, 分析结果如表 1所示。
|
图 2 氮源不同的二级出水中钝顶螺旋藻生长及pH的变化 Figure 2 Changes of biomass growth of Spirulina platensis and pH in secondary effluent with differentnitrogen sources |
| 表 1 钝顶螺旋藻生物量与二级出水中pH的相关性分析 Table 1 Correlation analysis of microalgae biomass and pH in secondary effluent |
氮源不同时, 螺旋藻生物量与二级出水pH值的相关性系数均大于0.916, 表现出显著相关性, 这表明二级出水中pH值的变化与微藻生物量的变化密切相关。钝顶螺旋藻在进行光合作用过程中过量摄取水体中的CO2, 破坏水体中HCO3-和CO32-的水解电离平衡使水体pH值持续增加, 且光合作用强度越大, 水体pH值越高[20-21]。由图 2(c)可知, 氮源不同时, 二级出水经钝顶螺旋藻处理后的最终pH值均高于9.0, 超出《城镇污水处理厂污染物排放标准》中一级A标准要求, 这一问题在实际操作中需要进一步解决。指出, 向微藻培养体系中通入CO2可以有效地将体系的pH控制在9.0以下, 同时可以提高微藻光合作用强度。
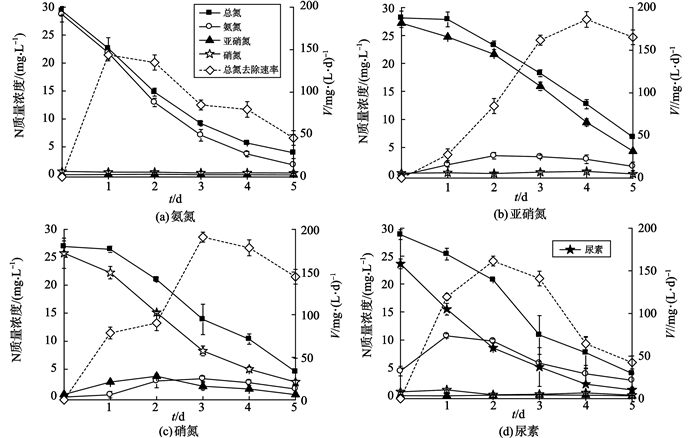
2.2 不同氮源下钝顶螺旋藻除氮性能及机理研究培养过程中, 每隔24 h取样测定废水中剩余的总氮、氨氮、硝氮、亚硝氮以探究钝顶螺旋藻的深度除氮性能。如图 3所示, 钝顶螺旋藻可以有效去除废水中的无机氮(氨氮、硝氮、亚硝氮)和有机氮(尿素)。当二级出水中的氮源分别为氨氮(质量浓度为29.3 mg/L)、硝氮(28.3 mg/L)、亚硝氮(28.6 mg/L)、尿素(29.1 mg/L)时, 处理5 d后, 总氮的质量浓度分别降至3.5、6.8、4.6、4.0 mg/L, 均达到《城镇污水处理厂污染物排放标准》中一级A标准要求。二级出水中的氮源分别为氨氮、硝氮、亚硝氮、尿素时, 体系中总氮的去除速率先上升后下降, 分别在处理1、4、3、2 d后达到最大, 其最大去除速率分别为143.7、186.0、190.1、161.4 mg/(g·d)。这表明污水中的氮形态会影响钝顶螺旋藻的除氮效率和速率。
|
图 3 钝顶螺旋藻的除氮性能及二级出水中氮形态的变化 Figure 3 Characteristics of N removal by Spirulina platensis and changes of N species in secondary effluent |
如图 3(a)所示, 钝顶螺旋藻可以有效去除二级出水中的氨氮, 培养5 d后, 溶液中氨氮的质量浓度从28.7 mg/L降至1.7 mg/L, 去除率达到93.9%。培养过程中, 总氮与氨氮的去除规律一致, 且体系中并没有检测到其它氮形式(亚硝氮, 硝氮), 表明氨氮是螺旋藻可以直接同化的氮源[23]。在亚硝氮培养体系中, 总氮、氨氮、硝氮、亚硝氮的含量变化如图 3(b)所示。钝顶螺旋藻可以有效去除二级出水中的亚硝氮, 培养5 d后, 二级出水中亚硝氮的质量浓度从27.2 mg/L降至4.3 mg/L, 去除率达到84.1%。与培养体形系中氮形式为氨氮时, 螺旋藻对氨氮的去除相比, 培养初期亚硝氮的去除速率较低, 可能是由于亚硝氮的生物毒性抑制了螺旋藻的生长, 进而降低其去除速率。培养0~1 d时, 总氮含量不变, 亚硝氮质量浓度由27.2 mg/L下降至23.7 mg/L, 氨氮质量浓度则由0 mg/L升高至3.8 mg/L, 且在整个培养过程中, 硝氮质量浓度基本保持不变, 这表明亚硝氮需还原为氨氮才能被螺旋藻同化。图 3(c)展示了二级出水中的氮源为硝氮时, 总氮、氨氮、硝氮、亚硝氮的质量浓度变化。钝顶螺旋藻可以有效去除二级出水中的硝氮, 培养5 d后, 二级出水中硝氮的质量浓度降至3.5 mg/L, 去除率达到86.7%。培养初期, 总氮质量浓度保持不变, 随着硝氮质量浓度的降低, 亚硝氮质量浓度先上升至3.8 mg/L后又降低至0.5 mg/L。此外, 体系中氨氮的质量浓度先保持不变, 然后上升至2.9 mg/L, 表明硝氮首先还原为亚硝氮, 亚硝氮再还原为氨氮才能被螺旋藻利用。综上所述, 在螺旋藻同化无机氮的过程中, 所有的无机氮都要转化为氨氮才能被利用[24]。硝酸盐氮首先在硝酸还原酶和烟酰胺腺嘌呤二核苷酸的协同作用下被还原为亚硝氮, 随后亚硝氮在亚硝酸还原酶和铁氧还蛋白的促进作用下转化为氨氮再被藻体同化合成蛋白质[16, 23]。
对于含尿素模拟二级出水, 钝顶螺旋藻对氮的去除情况及体系中氮形态的变化如图 3(d)所示。钝顶螺旋藻可以有效去除二级出水中的尿素, 培养5 d后, 溶液中尿素的质量浓度从23.6 mg/L降至1.7 mg/L, 去除率达到92.7%。培养1 d后, 体系中氨氮的质量浓度由4.4 mg/L升高至11.8 mg/L。这表明螺旋藻以尿素为氮源时首先要通过氨化作用将其分解为氨氮, 然后才能将其同化, 这一现象与文献[16]中提出的结论一致。在整个培养过程中, 硝氮和亚硝氮的浓度并未增加, 也从侧面证明钝顶螺旋藻能够直接同化氨氮。
2.3 氮平衡分别以氨氮、硝氮、亚硝氮和尿素为唯一氮源的钝顶螺旋藻培养体系中, 氮在藻体和上清液中的分布如图 4所示。

|
图 4 培养前后, 不同氮形态对总氮在藻体和上清液中分布的影响 Figure 4 Effect of different nitrogen species on the distributionof total nitrogen in microalgae biomass and supernatant at first and last day |
当二级出水中的氮源分别为氨氮、硝氮、亚硝氮、尿素时, 培养5 d后, 藻体和上清液中的总氮的百分比分别为14.7%、17.2%、16.4%、15.3%和77.8%、75.8%、79.0%、78.6%。在传统污水生物处理过程中, 污水中氮的同化率只有20%~30%, 其余的氮都以氮气或者氮氧化气体的形式流失, 使污水中的氮大量浪费。而钝顶螺旋藻可以同化二级出水中75%以上的氮, 有效实现废水中氮的回收。且由图 4可知, 培养5 d后, 钝顶螺旋藻培养体系内还发生了部分氮损失, 分别为10.7%(氨氮), 4.1%(亚硝氮), 6.9%(硝氮), 9.6%(尿素), 氮损失的百分比随二级出水最终pH值的增加而增大。有研究证明, 微藻培养体系中的氮损失主要为氨挥发, 氨挥发的快慢与水体的温度及pH值相关, 在室温条件下, 当水体的pH值超过9.27时, 氨挥发就会发生[25-27]。文献[25]中指出, 在开放的藻类高效氧化塘中处理城市生活污水时, 氨挥发可以占到总氮去除率的25%~37%。在本次研究中, 随着水体中CO2的消耗, 合成二级出水中pH不断升高, 最终pH均在9.5以上, 为氨挥发提供了条件。
3 结论钝顶螺旋藻在低碳氮比二级出水中生长并有效其中的无机氮(氨氮、亚硝氮、硝氮)和有机氮(尿素), 培养5 d后, 总氮的质量浓度均达到《城镇污水处理厂污染物排放标准》中一级A标准。氨氮是钝顶螺旋藻可以直接同化的氮源, 无机氮和有机氮需转化为氨氮才能被利用:硝氮首先被还原亚硝氮再还原为氨氮; 有机氮(尿素)则需经过氨化作用分解为氨氮。二级出水中75%以上的氮都被微藻同化积累在藻体内, 还有少部分氮通过氨挥发的形式被去除。综上所述, 本研究为二级出水中氮的深度处理提供了有价值的解决方案。
| [1] | 史媛媛. 微藻法污水处理研究与进展[J]. 青海科技, 2009(5): 58-60 DOI:10.3969/j.issn.1005-9393.2009.05.021 |
| [2] | 佚名. 环境保护部发布《2014年中国环境状况公报》[J]. 中国环境科学, 2015(6): 1379-1379 |
| [3] | 司友斌, 王慎强, 陈怀满. 农田氮、磷的流失与水体富营养化[J]. 土壤, 2000(4): 188-193 DOI:10.3321/j.issn:0253-9829.2000.04.005 |
| [4] | 方先金. 城镇污水处理厂二级出水深度脱氮研究[J]. 水工业市场, 2012(4): 44-46 |
| [5] | DU Rui, CAO Shenbin, WANG Shuying, et al. Performance of partial denitrification (PD)-ANAMMOX process in simultaneously treating nitrate and low C/N domestic wastewater at low temperature[J]. Bioresource Technology, 2016, 219: 420-429 DOI:10.1016/j.biortech.2016.07.101 |
| [6] |
沈耀良, 孙立柱, 王德兴, 等. 混凝沉淀工艺深度处理污水厂二级出水的混凝剂优化[J].
中国给水排水, 2007, 23(23): 56-62 SHEN Yaoliang, SUN Lizhu, WANG Dexing, et al. Coagulant optimization of cougulation and sedimentation processes for advanced treatment of secondary effluent from municipal WWTP[J]. China Water & Wastewater, 2007, 23(23): 56-62 DOI:10.3321/j.issn:1000-4602.2007.23.013 |
| [7] | 杨纪伟, 武燕蕾, 田婵婵, 等. 三维电极法深度处理城市污水处理厂二级出水[J]. 人民黄河, 2011, 33(1): 73-74 DOI:10.3969/j.issn.1000-1379.2011.01.030 |
| [8] | ZHOU Weizhi, LI Yating, GAO Yizhan, et al. Nutrients removal and recovery from saline wastewater by Spirulina platensis[J]. Bioresource Technology, 2017, 245: 10-17 DOI:10.1016/j.biortech.2017.08.160 |
| [9] |
杨小龙, 李文明, 陈燕, 等. 一株好氧反硝化菌的分离鉴定及其除氮特性[J].
微生物学报, 2011, 51(8): 1062-1070 YANG Xiaolong, LI Wenming, CHEN Yan, et al. Identification and denitrification of an aerobic bacterium[J]. Acta Microbiologica Sinica, 2011, 51(8): 1062-1070 |
| [10] | WANG Xiaoxia, WANG Shuying, XUE Tonglai, et al. Treating low carbon/nitrogen (C/N) wastewater in simultaneous nitrification-endogenous denitrification and phosphorous removal (SNDPR) systems by strengthening anaerobic intracellular carbon storage[J]. Water Research, 2015, 77: 191-200 DOI:10.1016/j.watres.2015.03.019 |
| [11] | MANNINA G, CAPODICI M, COSENZA A, et al. Carbon and nutrient biological removal in a university of cape town membrane bioreactor: analysis of a pilot plant operated under two different C/N ratios[J]. Chemical Engineering Journal, 2016, 296: 289-299 DOI:10.1016/j.cej.2016.03.114 |
| [12] |
胡章喜, 徐宁, 段舜山. 不同氮源对4种海洋微藻生长的影响[J].
生态环境学报, 2010, 19(10): 2452-2457 HU Zhangxi, XU Ning, DUAN Shunshan. Effects of nitrogen sources on the growth of Heterosigma akashiw, Karenia sp.[J]. Ecology and Environmental Sciences, 2010, 19(10): 2452-2457 DOI:10.3969/j.issn.1674-5906.2010.10.033 |
| [13] | GE Shijian, CHAMPAGNE P. Nutrient removal, microalgal biomass growth, harvesting and lipid yield in response to centrate wastewater loadings[J]. Water Research, 2016, 88: 604-612 DOI:10.1016/j.watres.2015.10.054 |
| [14] | KLANCHUI A, KHANNAPHO C, PHODEE A, et al. iAK692: A genome-scale metabolic model of Spirulina platensis c1[J]. BMC Systems Biology, 2012, 6: 1-15 |
| [15] | PHANG S M, MIAH M S, YEOH B G, et al. Spirulina cultivation in digested sago starch factory wastewater[J]. Journal of Applied Phycology, 2000, 12: 395-400 DOI:10.1023/A:1008157731731 |
| [16] | CHANG Yuanyuan, WU Zucheng, BIAN Lei, et al. Cultivation of Spirulina platensis for biomass production and nutrient removal from synthetic human urine[J]. Applied Energy, 2013, 102: 427-431 DOI:10.1016/j.apenergy.2012.07.024 |
| [17] | GODIA F, ALBIOL J, MONTESINOS J, et al. MELISSA: a loop of interconnected bioreactors to develop life support in space[J]. Journal of Biotechnology, 2002, 99(3): 319-330 DOI:10.1016/S0168-1656(02)00222-5 |
| [18] | 国家环境保护总局科技标准司. 城镇污水处理厂污染物排放标准: GB18918—2002[S/OL]. 北京: 中国环境出版社, 2001: 3-4. [2006-01-01]. https://wenku.baidu.com/view/e522aeb24693daef5ef73dcc.html. |
| [19] | 魏复盛, 齐文启. 水和废水的分析检测方法[M]. 北京: 中国环境科学出版社, 2002: 254-284. |
| [20] | ANDRADE M R, COSTA J A. Mixotrophic cultivation of microalga Spirulina platensis using molasses as organic substrate[J]. Aquaculture, 2007, 264(1): 130-134 |
| [21] | DEPRAETERE O, PIERRE G, DESCHOENMAEKER F, et al. Harvesting carbohydrate-rich Arthrospira platensis by spontaneous settling[J]. Bioresource Technology, 2015, 180: 16-21 DOI:10.1016/j.biortech.2014.12.084 |
| [22] | PARK Y I, LABRECQUE M, LAVOIE J M. Influence of elevated CO2 and municipal wastewater feed on the productivity, morphology, and chemical composition of Arthrospira (Spirulina) platensis[J]. ACS Sustainable Chemistry & Engineering, 2013, 1(11): 1348-1356 |
| [23] | CAI Ting, PARK S, LI Yebo. Nutrient recovery from wastewater streams by microalgae: status and prospects[J]. Renewable and Sustainable Energy Reviews, 2013, 19: 360-369 DOI:10.1016/j.rser.2012.11.030 |
| [24] | BLOOM A J, SUKRAPANNA S S, WARNER R L. Root respiration associated with ammonium and nitrate absorption and assimilation by barley[J]. Plant Physiol, 1992, 99(4): 1294-1301 DOI:10.1104/pp.99.4.1294 |
| [25] | GARCIA J, MUJERIEGO R, HERNANDEZ M. High rate algal pond operating strategies for urban wastewater nitrogen removal[J]. Journal of Applied Phycology, 2000, 12: 331-339 DOI:10.1023/A:1008146421368 |
| [26] |
庄源益, 戴树桂, 张明顺. 水中氨氮挥发影响因素探讨[J].
环境化学, 1995, 14(4): 343-346 ZHUANG Yuanyi, DAI Shugui, ZHANG Mingshun. A preliminary study on factors influened the volatilization of ammonia from water[J]. Environmental Chemistry, 1995, 14(4): 343-346 |
| [27] | MARKOU G, GEORGAKAKIS D. Cultivation of filamentous cyanobacteria (blue-green algae) in agro-industrial wastes and wastewaters: a review[J]. Applied Energy, 2011, 88(10): 3389-3401 DOI:10.1016/j.apenergy.2010.12.042 |




